Peser une à une des fibres de protéines
Grâce à une nouvelle technique de spectrométrie de masse unique en Europe, des physiciens ont réussi, pour la première fois, à peser une à une des fibres amyloïdes et à déterminer ainsi le nombre de protéines qui les composent. Trop légers pour des balances et trop lourds pour les spectromètres de masse traditionnels, ces assemblages de protéines qui jouent un rôle majeur dans la maladie d’Alzheimer ou de Parkinson, échappaient jusqu’à présent à une caractérisation quantitative.
Agrégats de protéines hautement organisées, les fibres amyloïdes suscitent un grand intérêt en raison de leur implication dans les maladies neurodégénératives telles que les maladies d’Alzheimer et de Parkinson. Elles suscitent en outre un intérêt croissant du côté des nanotechnologies, en raison notamment de leurs propriétés d’auto-assemblage. Pourtant, en dépit des nombreuses recherches effectuées sur ces objets, des informations physiques de base telles que leur masse sont toujours inconnues. Des physiciens de l’ILM (CNRS/Univ. Lyon 1) en collaboration avec des biologistes du LCBM (CNRS/CEA/Univ. Grenoble Alpes) viennent pour la première fois de peser individuellement des fibres amyloïdes. Cette nouvelle technique, combinée à la microscopie par force atomique (AFM, réalisée au CEA Grenoble), ouvre la voie à une détermination quantitative de la densité des assemblées supramoléculaires de protéines, une information essentielle pour mieux comprendre la formation et l’accumulation des fibres dans le cerveau ainsi que le rôle du polymorphisme dans les phénomènes de « déformation » (strain phenomenon) décrits dans les maladies liées aux amyloïdes. Les résultats sont publiés dans la revue Angewandte Chemie International Edition.
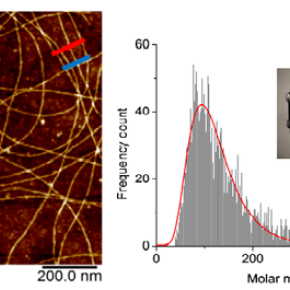
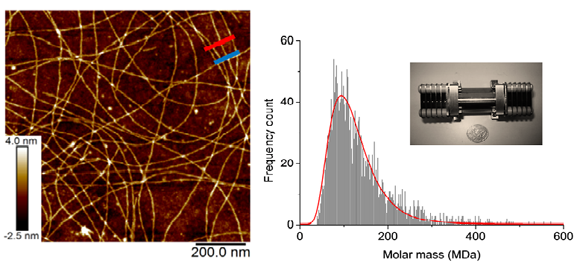
Dans cette expérience, les physiciens ont étudié des fibres amyloïdes de longueur micrométrique, obtenues par incubation d’alpha-lactalbumine (ou HET-s) en milieu acide. A partir d’une solution diluée contenant ces fibres, ils produisent alors un aérosol de gouttelettes chargées à l’aide d’un électronébuliseur. Les gouttelettes, qui contiennent au maximum une fibre, s’évaporent. Il reste alors un jet de fibres chargées qui passent, sous vide, une à une à l’intérieur d’un tube en inox de 3.75 cm de long et de 6.35 mm de diamètre interne. Au passage de la fibre, le tube acquiert une charge électrique identique et de signe opposé à la charge de la fibre, qu’il est alors possible de mesurer. Associée au temps de traversée de la fibre dans le tube, cette mesure permet ainsi d’accéder à la masse de chacune des fibres. Cela a permis aux chercheurs de déterminer que les fibres étudiées dans ce travail pèsent en moyenne 1.82 10-16 grammes, ce qui représente 110 millions d’unités de masse atomique, soit environ 13 000 protéines HET-s par fibre. En répétant cette mesure sur un grand nombre de fibres, les chercheurs ont également déterminé la distribution de masse et montré la très grande dispersion de masse dans l’échantillon.
En savoir plus
Mass Determination of Entire Amyloid Fibrils by Using Mass Spectrometry
Tristan Doussineau1, Carole Mathevon2, Lucie Altamura2, Charlotte Vendrely3, Philippe Dugourd1, Vincent Forge2 et Rodolphe Antoine1, Angewandte Chemie International Edition, le 3 février 2016.
Informations complémentaires
1 Institut Lumière Matière (ILM)
2 Laboratoire de Chimie et Biologie des Métaux (LCBM)
3 Equipe de Recherche sur les relations Matrice extracellulaire-Cellule (Errmece) et Laboratoire des Matériaux et du Génie Physique (LMGP)