La loi de la cryoscopie revisitée par les nanosciences
Des physiciennes et des physiciens ont mis en évidence que l'ajout de glycérol n'abaisse pas la température de fusion d'un glaçon de taille nanométrique, contrairement à ce que l'on observe aux échelles supérieures.
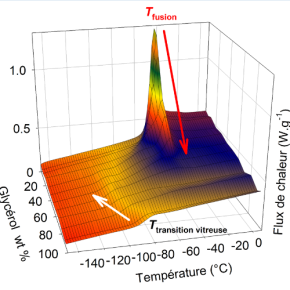
En dissolvant un composé dans l’eau (sel, glycol, sucre…), on abaisse d’autant la température de fusion de la glace. Ce phénomène très important de la physico-chimie des solutions, dénommé effet cryoscopique, constitue l’une des 3 lois de Raoult (1830-1901). Il justifie le salage des routes enneigées en hiver, les additifs antigel dans le liquide des radiateurs de voitures, la cryopréservation de tissus biologiques… Mais il existe une autre voie pour abaisser le point de fusion : diminuer la taille de l'échantillon. Ainsi, un grain de glace de 3,6 nm de diamètre fond dès -43 °C, une conséquence connue de l'effet Gibbs-Thomson. Mais qu'en est-il si l'on ajoute en plus un soluté ? Les effets se cumulent-ils ? Des chercheurs de l’Institut de physique de Rennes (IPR, CNRS/Univ. Rennes 1) ont montré que non, ce qui semble contredire l'effet cryoscopique à l’échelle nanoscopique.
Pour ce faire, les chercheurs ont utilisé des matériaux de silice poreuse présentant des canaux de quelques nanomètres de diamètre, utilisés comme des sortes de tubes à essai. Ils ont détecté par une méthode calorimétrique la cristallisation et la fusion de solutions aqueuses de glycérol. Ce dernier a été choisi car il est largement utilisé comme agent cryoprotecteur. Il se trouve aussi dans de nombreuses compositions cosmétiques ou pharmaceutiques. Un modèle théorique a permis d'interpréter ce phénomène. Le point de fusion est la température à laquelle les molécules d’eau formant la glace et celles présentes dans la solution sont à l’équilibre thermodynamique. Autrement dit, elles contribuent identiquement à l’énergie libre des deux phases. L'ajout d'un soluté abaisse le point de fusion car il déplace cet équilibre en diminuant l’activité chimique de l’eau dans la solution, qui est elle-même reliée à la concentration. Cela conduit à la fusion précoce du glaçon. Cet effet cryoscopique ne se produit plus à l'échelle nanoscopique à cause d'un phénomène de ségrégation spatiale entre l'eau et le soluté. Le cristal ne baigne pas dans une solution aqueuse, mais dans de l'eau presque pure. Son point de fusion n'est pas donc pas changé.
La meilleure compréhension et la prise en compte de ce phénomène pourrait avoir un impact dans les nombreux domaines où le contrôle de la cristallisation de grains nanométriques de glace est central, comme en biologie ou en sciences de l’environnement.
Référence
Extension and Limits of Cryoscopy for Nanoconfined Solutions. Benjamin Malfait, Alban Pouessel, Aîcha Jani et Denis Morineau, The journal of physical chemistry letters, le 26 juin 2020.
DOI : 10.1021/acs.jpclett.0c01564.
Article disponible sur la base d'archives ouvertes HAL.