Transition liquide-liquide et second point critique dévoilés dans le soufre
L'existence de deux phases liquides de densités distinctes a été démontrée pour la première fois dans le soufre. L'équipe de chercheurs et de chercheuses a également mis en évidence un second point critique entre ces deux phases, une caractéristique prédite et recherchée dans l’eau depuis presque 30 ans.
Toute substance peut exister à l’état liquide et gazeux, et passer de l’un à l’autre en fonction de la pression (P) ou de la température (T). Pour des conditions P, T en dessous des conditions dites « critiques », le changement d’état est caractérisé par une variation soudaine et importante de la densité. Lorsqu’on se rapproche puis dépasse les conditions critiques (qui définissent un point dans le plan P-T dit point critique), le saut de densité diminue puis s’annule. On passe alors du gaz au liquide de façon continue : c’est l’état « fluide » ou « supercritique ». Au voisinage du point critique, la matière "hésite" entre l'état liquide et l'état gazeux, produisant des fluctuations géantes de densité : c’est le phénomène d’opalescence critique. Les fluides supercritiques sont utilisés massivement dans l’industrie chimique car ce sont d’excellents solvants. Dans les années 90, un second point critique a été suggéré dans l'eau à partir de simulations numériques. Celui-ci terminerait une ligne de transition dans le plan P-T séparant cette fois deux phases liquides. Mais il n'a jamais pu être observé expérimentalement.
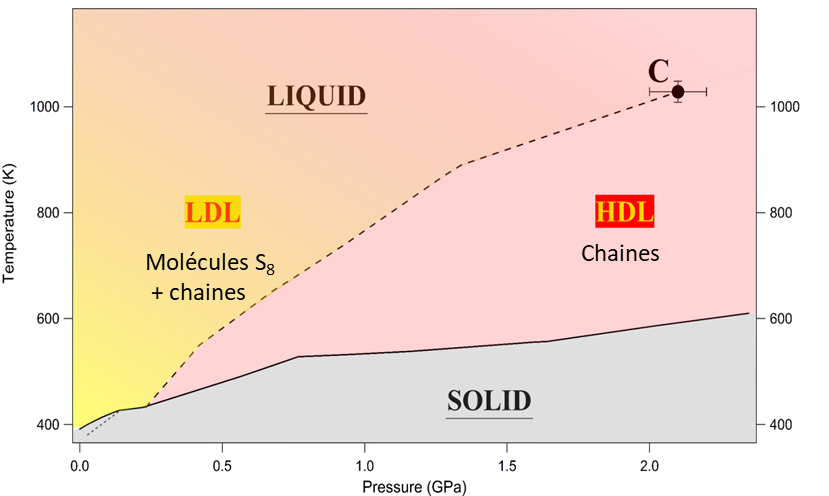
Dans cette étude, des chercheurs et des chercheuses du synchrotron européen ESRF, de l’Institut de minéralogie, de physique des matériaux et de cosmochimie (IMPMC, CNRS/MNHN/Sorbonne Univ./IRD), et du CEA ont étudié le comportement du soufre liquide dans la zone 0-30 kbar, 300-1100 K. L’équipe a démontré qu’une transition liquide-liquide existe dans le soufre et elle a déterminé la ligne de transition dans le plan P-T [Fig. 1]. Il s’agit seulement du deuxième exemple de transition liquide-liquide observée dans un liquide mono-composant et thermodynamiquement stable, après le phosphore. Ce travail est aussi le premier à montrer expérimentalement l’existence d’un second point critique associé à la transition liquide-liquide, terminant la ligne de transition (point C dans la Fig. 1). En effet, en faisant varier la pression à une température supérieure à 1050 K, les scientifiques ont observé que la densité évolue continûment, contrairement aux sauts observés à plus basse température. Ceci indique la présence d’un point critique situé vers 21.5 kbar et 1035 K. La variation du saut de densité le long de la transition est également intrigante : en s’éloignant du point critique, le saut de densité commence par augmenter puis passe par un maximum à environ 750 K avant de chuter. C’est un comportement bien différent de celui de la transition liquide-gaz, pour laquelle le saut de densité augmente de façon monotone en s’éloignant du point critique.
Pour parvenir à ces résultats, l'équipe a dû mettre au point un support totalement inerte, le soufre étant un composé très réactif. Elle a ainsi réalisé une capsule en diamant d'un millimètre de diamètre, fermée par un bouchon en chlorure de sodium. Les mesures ont eu lieu à l'ESRF, grâce à des faisceaux de rayons X dirigés vers l'échantillon. L'absorption des rayons X renseigne sur la densité du soufre, et la diffraction révèle son organisation au niveau atomique. L’équipe a ainsi pu démontrer que le liquide de haute densité est essentiellement composé de chaînes d’atomes de soufre, alors que celui de basse densité contient à la fois des molécules S8 et des chaînes.
Cette étude devrait permettre d’avancer dans la compréhension physique de ce phénomène, et par extension, de celle de l’état liquide et notamment l'existence d'un second point critique dans l'eau. De plus, les conditions P-T du point critique étant relativement facile d’accès, il ouvre des perspectives très intéressantes pour la caractérisation des phénomènes critiques (comme l’opalescence observée dans la transition liquide-gaz) associés aux transitions liquide-liquide. Une meilleure compréhension des transitions liquide-liquide pourrait également aboutir à de nouvelles applications fondées sur le contrôle des propriétés physiques du liquide.
Référence
Liquid–liquid transition and critical point in sulfur. Laura Henry, Mohamed Mezouar, Gaston Garbarino, David Sifré, Gunnar Weck & Frédéric Datchi, Nature, le 19 août 2020.
DOI: 10.1038/s41586-020-2593-1
Article disponible sur la base d’archives ouverte HAL.
