Une nouvelle méthode de microscopie pour observer les mécanismes cellulaires
Les images de microscopie de fluorescence super-résolue, c'est-à-dire résolue à l'échelle nanométrique, sont un outil essentiel pour la compréhension des mécanismes cellulaires. Un pas en avant est franchi ici pour s'affranchir de biais de mesure et ainsi améliorer significativement les informations tridimensionnelles obtenues.
Pour observer les molécules au sein d'une cellule grâce à un microscope, des marqueurs fluorescents sont fixés sur celles-ci et la répartition spatiale de la lumière émise est détectée : c'est le principe de la microscopie de fluorescence. Elle a connu une véritable révolution avec l’avènement des techniques de super-résolution (récompensé par le prix Nobel de chimie en 2014) qui permettent de former des images en s'affranchissant de la limite de diffraction, avec une résolution qui est ainsi passée de plusieurs centaines à une dizaine de nanomètres. Différents phénomènes, comme les dérives mécaniques ou thermiques existant à l'échelle de temps de la mesure ou les problèmes de chromatisme, limitent cependant la précision des microscopes, notamment dans la direction axiale où la profondeur à laquelle la meilleure résolution accessible est restreinte. Des physiciens de l’Institut des sciences moléculaires d’Orsay (ISMO, CNRS/Univ. Paris-Sud) et de l’Institut Langevin (CNRS/ESPCI) et du Centre de photonique biomédicale (CPBM, Univ. Paris-Sud) ont mis au point une nouvelle méthode pour s'affranchir des dérives et du chromatisme, tout en permettant de sonder un échantillon jusqu'à un micromètre de profondeur. La précision axiale, de l'ordre de 15 nm, est comparable à la précision latérale et est obtenue sans nécessité de correction des biais de mesure. L'obtention et l'interprétation des images est ainsi grandement simplifiée.
Pour cela, les physiciens ont combiné la méthode SAF (microscopie de fluorescence supercritique) et la méthode d’astigmatisme basée sur l’introduction d’une aberration déformant de façon contrôlée la fonction réponse de l’instrument. La première méthode met en oeuvre des propriétés particulières de la fluorescence émise près de la lamelle de verre sur laquelle les cellules sont déposées et utilise un système à deux voies pour une double détection, axiale et latérale. Elle est intrinsèquement insensible aux effets de dérives et aux effets chromatiques, mais est limitée à 300 nm en profondeur. Par ailleurs, en introduisant une lentille cylindrique, la sensibilité suivant la direction axiale est accrue et le signal venant de molécules profondes peut être détecté grâce à la méthode d'astigmatisme. Celle-ci permet donc de sonder plus loin en profondeur mais reste sensible aux dérives. Dans ce travail, en exploitant les possibilités offertes par l'introduction une lentille cylindrique dans le système de détection SAF double voie, les chercheurs ont mis au point une méthode de microscopie qu'ils ont appelée DAISY1
et qui donne directement, de façon absolue et fiable, des images précises sur une profondeur accrue.
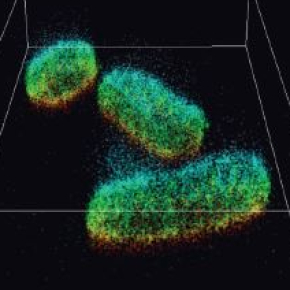
L'imagerie par microscopie de fluorescence permet de voir et d'analyser la structure des cellules, un objectif majeur étant de comprendre les liens entre structure et fonction. Elle suscite une recherche très interdisciplinaire. En collaboration avec des collègues chimistes (ISCN, CNRS), spécialistes du marquage de la fluorescence, des bactéries ont été observées en 3 dimensions avec la méthode DAISY avec une précision quasi isotrope (figure 1). En collaboration avec des neurobiologistes (INP, CNRS/Aix-Marseille Université), la méthode DAISY a également été mise en oeuvre pour une étude concernant différentes protéines des neurones (figure 2). De nombreuses recherches en biologie devraient pouvoir bénéficier de cette nouvelle technique qui offre des avantages uniques en termes d’imagerie cellulaire tridimensionnelle2
.
Référence
Combining 3D single molecule localization strategies for reproductible bioimaging.
Clément Cabriel, Nicolas Bourg, Pierre Jouchet, Guillaume Dupuis, Christophe Leterrier, Aurélie Baron, Marie-Ange Badet-Denisot, Boris Vauzeilles, Emmanuel Fort et Sandrine Lévêque-Fort,
Nature Communications, le 30 avril 2019. DOI: 10.1038/s41467-019-09901-8
Lire l’article sur la base d’archives ouvertes HAL