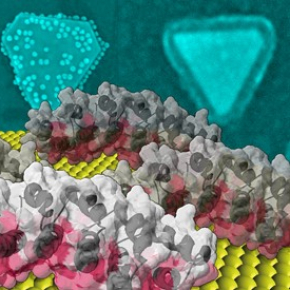
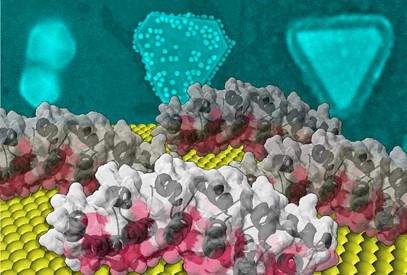
Des protéines formées à la nano-orfèvrerie
Des physico-chimistes et des biochimistes ont créé et optimisé, par évolution dirigée, des protéines artificielles reconnaissant spécifiquement une orientation cristalline de l'or. Lors de la croissance de nanoparticules, ces protéines en contrôlent la forme, la cristallinité et les propriétés de surface.
Dans la nature, il existe beaucoup d'exemples de protéines, sélectionnées par l'évolution, qui contrôlent la croissance de biomatériaux inorganiques, tels que l’émail ou la nacre. Pourrait-on créer des protéines capables de contrôler la forme, la cristallinité et la taille de nanostructures d'un matériau inorganique choisi ? S'il est encore impossible de concevoir ex nihilo quelle devrait être la structure de telles protéines, il est en revanche imaginable d'en faire émerger en suivant le principe de l'évolution dirigée, c'est-à-dire en reconstituant un processus évolutif en laboratoire. L'évolution dirigée est utilisée en biologie où elle a un impact considérable1
, en particulier dans le développement de thérapeutiques ciblées. Une stratégie consiste à construire des bibliothèques de milliards de peptides ou d'anticorps, tous différents les uns des autres, et portés, chacun, par un virus (non pathogène). Les virus sont exposés à une cible et les très rares individus qui s'accrochent le plus fortement à la cible sont conservés puis très abondamment clonés. Il est alors aisé d'identifier puis de produire le peptide ou l'anticorps responsable de cette interaction extrêmement spécifique. Dans ce travail, des physico-chimistes du Centre d’élaboration de matériaux et d’études structurales (CEMES, CNRS) à Toulouse et des biochimistes de l'Institut de biologie intégrative de la cellule (I2BC, CNRS/Univ. Paris-Sud/CEA) à Gif-sur-Yvette ont joint leurs recherches et ont, pour la première fois, appliqué l'évolution dirigée pour identifier des protéines capables d'interagir spécifiquement avec une cible métallique : une surface d'or dont l'orientation des plans atomiques est bien définie, l'orientation 111. Ils ont réussi à isoler, identifier et produire neuf protéines présentant une forte affinité avec ces plans atomiques à partir d'une bibliothèque de deux milliards de protéines artificielles. Introduites ensuite lors de la synthèse de nanoparticules d'or, ces protéines se sont révélées efficaces pour forcer la croissance de formes présentant des facettes de même orientation 111. Par rapport à des peptides issus de l’évolution dirigée, les protéines, plus grandes et plus rigides, se révèlent ici capables de contrôler la croissance de particules monocristallines de grande taille, 50 à 500 nanomètres, au lieu de quelques nanomètres seulement.
Il existe dans le monde encore très peu de bibliothèques de protéines artificielles et celle de l'I2BC est le fruit d'une construction qui a duré une dizaine d'années afin de disposer d'une famille la plus large et la plus diverse possible de protéines qui soient très stables, partageant une même architecture générale, mais se distinguant par une de leurs faces, dite hypervariable. Selon les protéines, cette face contient entre 12 et 60 acides aminés (soit 20 % du nombre total d'acides aminés), dont la nature est différente d'une protéine à l'autre. L'interaction avec la surface d'or via cette face est ainsi spécifique à chaque protéine. Le protocole de sélection des protéines ayant une forte affinité avec la surface d'or est semblable au protocole d'évolution dirigée utilisé pour des cibles biologiques. Les deux milliards protéines portées par des virus sont mises en interaction avec une surface d'or d'une dizaine de cm2 au sein d'une solution saline neutre. Un rinçage élimine celles qui interagissent le plus faiblement, un décrochage acide permet de récupérer les virus portant les protéines les plus adhérentes puis de les cloner avant de les remettre en interaction avec la surface d'or. Au bout de trois opérations, neuf protéines ayant une interaction particulièrement forte sont sélectionnées. Celles-ci sont ensuite introduites dans le protocole de synthèse de nanocristaux d'or. Les chercheurs montrent que les protéines contrôlent la forme des nanocristaux obtenus, pouvant ainsi privilégier des décaèdres, des icosaèdres et des plaquettes, dont les facettes sont très majoritairement orientées suivant des plans cristallins 111. En effet, en adhérant sur les faces 111 qui se forment lors de la croissance, les protéines les "protègent" et la croissance se poursuit par l'intermédiaire des autres orientations cristallines. Au-delà de la synthèse, accrochées sur les facettes des nanocristaux, les protéines deviennent les outils de leur fonctionnalisation. Dans ce travail, elles ont pu être modifiées chimiquement pour induire l'auto-assemblage des nanocristaux obtenus ou pour déclencher une réaction enzymatique locale en surface (figure).
Les propriétés optiques, de fonctionnalisation et de biocompatibilité des nanoparticules d'or leur confèrent un vaste potentiel d'applications, notamment dans le domaine biomédical. Ces résultats constituent une approche générique de la construction de nanocristaux à forme spécifique et à propriétés modulables biochimiquement qui pourra être mis à profit pour ces applications.
- 1Elle a valu le Prix Nobel de Chimie à F. Arnold, G. Smith et G. Winter en 2018.
Références
Directed evolution of artificial repeat proteins as habit modifiers for the morphosynthesis of (111) terminated gold nanocrystals. J. Prasad, S. Viollet, G. K. L, A. Urvoas, A. Fournier, M. Valerio-Lepiniec, C. Garcia-Marcelot, B. Baris, P. Minard et E. Dujardin. Nanoscale, le 26 août 2019.
DOI: 10.1039/C9NR04497C